[메디게이트뉴스 서민지 기자] 최근 미국, 일본에 이어 우리나라 정부도 렘데시비르를 신종코로나바이러스감염증(COVID-19·코로나19) 치료제로 활용하는 가운데, 아직까지 유효성과 안전성이 제대로 증명되지 않아 최소한으로 일부 제한된 범위에서만 사용해야 한다는 주장이 나왔다.
9일 약학정보원 학술정보센터는 코로나19 치료제로 활용·연구되는 렘데시비르 팜리뷰를 통해 이같이 밝히면서, 제대로 설계된 추가 임상시험이 필요하다고 제언했다.
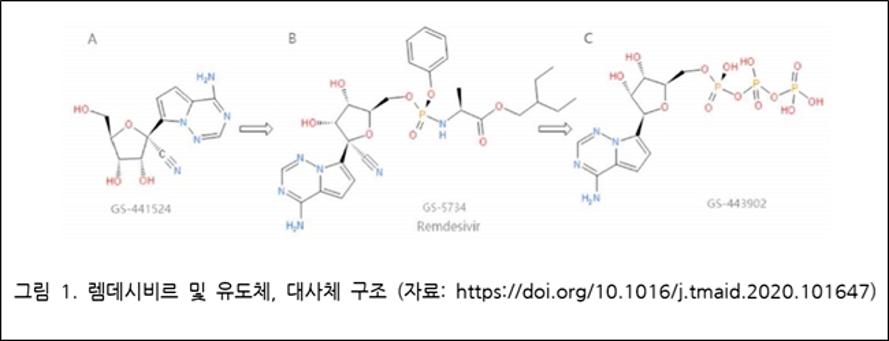
렘데시비르(remdesivir, GS-5734)는 구조적으로 뉴클레오시드 유사체(nucleoside analog)다. 처음 개발 된 형태는 GS-441524로 코로나바이러스에 의한 고양이의 전염성 복막염(FIP) 치료제로 승인된 약물인데, 여기에 인산기를 포함하는 그룹을 추가했다.
RNA-의존성 RNA 중합효소(RNA-dependent RNA polymerase, RdRp)를 타겟으로 하며, 길리어드 사이언스는 에볼라 바이러스 치료제 개발 중 GS-441524의 효능을 확인하고 이 구조를 최적화해 렘데시비르(GS-5734)를 도출했다.
전구약물(prodrug)인 렘데시비르는 정맥 주사 후, 체내에서 세포 대사를 통해 활성형인 GS-443902로 변환돼 ATP와 유사한 구조로서 RNA 중합효소를 저해한다.
최근 미국국립보건원(NIH) 산하 기관인 알레르기 감염병 연구소(NIAID)에서 발표한 대규모 임상 초기 데이터에서 렘데시비르(remdesivir)가 중증 COVID-19 환자의 회복 기간을 감소시키는 것으로 나타났다.
이에 따라 미국 식품의약국(FDA)은 5월 1일 호흡 장애로 인공호흡기 등이 필요 한 COVID-19 중증 입원 환자에 렘데시비르의 긴급 사용 승인(Emergency Use Authorization, EAU)을 발표했다.
긴급 사용 승인은 연구 진행 중인 단계로 대체 약이 없는 상황 등에서 의약품 사용이 가능하도록 하는 조치다.
다만 약학정보원은 아직 사람에서 치료제로 정식 승인되지 않은 약물로, 안전성과 유효성에 대한 입증이 필요하다고 밝혔다.
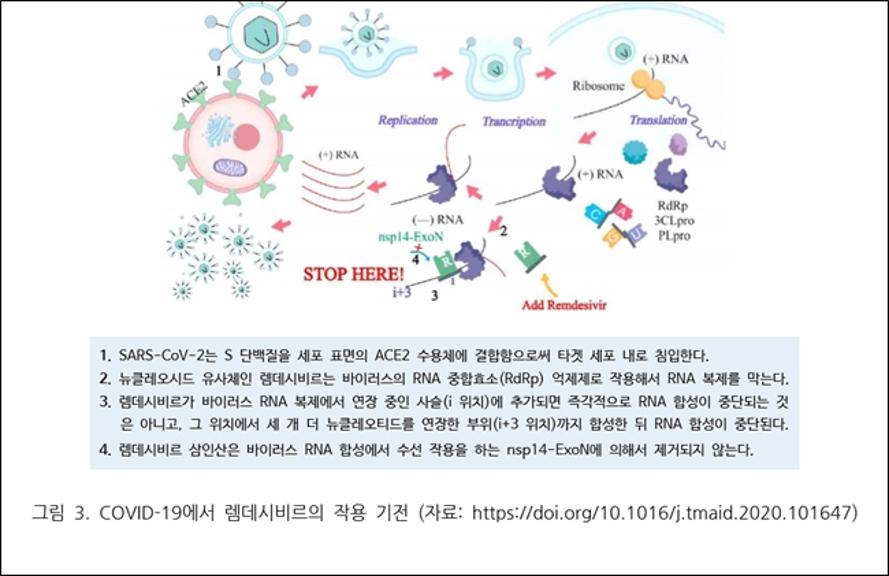
약학정보원은 "코로나바이러스의 RNA-의존성 RNA 중합효소가 RNA를 합성하며, 렘데시비르는 호흡기 상피 세포에서 이 효소를 억제해 코로나바이러스의 복제를 막는다"면서 "뉴클레오시드 분자와 구조가 비슷한 렘데시비르는 체내에 서 활성형인 렘데시비르 삼인산으로 변환되는데, 이는 아데노신 삼인산(ATP)과 유사한 구조로 자연적으로 존재하는 ATP와 경쟁해 중합 과정에서 대신 삽입, 복제 과정을 중단시킨다"고 설명했다.
이어 "특징적인 것은 사슬에 삽입돼 즉각적으로 합성을 차단하는 여타의 사슬 종결제와 달리, 렘데시비르는 연장 중인 RNA 사슬에 몇 개 염기를 추가된 후 합성을 종료시키는 지연사슬 종료(delayed chain-termination)를 일으킨다"고 덧붙였다.
현재 미국에 이어 우리나라도 렘데시비르에 대해 특례수입을 허가해 중증환자에 쓸 수 있도록 하고 있다.
그러나 약학정보원은 "미국의 최초 확진자에서 렘데시비르의 동정적 사용(compassionate use)으로 증상이 호전되면서 COVID-19 치료 후보로서 가능성이 제시돼 임상 시험이 진행되고 있다"면서 "지난 4월 NEJM 저널에 발표된 렘데시비르 임상 결과에서도 투여 후 53명 중 36명의 중증환자가 임상적 개선을 보였으나, 대조군 없이 진행되어 결과 해석에 한계가 있다"고 밝혔다.
이어 "미국 알레르기 감염병 연구소(NIAID)가 진행한 1063명의 대규모 3상 임상에서 렘데시비르 복용 시, 위약 대비 회복에 걸리는 시간을 31% 단축했다"면서 "이 역시 통계적으로 유의하지 않은 것으로 나타났다"고 설명했다.
이외에도 란셋 저널에는 중국에서 수행한 237명 대상 임상에서 렘데시비르가 위약 대비 임상적 개선에 이르는 시간을 단축시켰으나, 통계적으로 유의하지 않다는 상반된 결과를 보고했다.
약학정보원은 "연구 결과 해석에 논란이 있으며 연구마다 상반된 결과가 제시되고 있어 최종 유효성 결과에 관심이 쏠리고 있다"면서 "더욱이 안전성 역시 논란이 있어 진행 중인 대규모 임상 결과를 통해 안전성 평가가 가능할 것"이라고 밝혔다.
실제 그간 연구에서 렘데시비르의 흔한 부작용으로는 호흡 부전, 혈중 알부민 수치 감소, 칼슘 수치, 적혈구 수, 혈소판 수의 저하 등이 나타났고, 이외에도 위장관 장애, 혈중 간효소 transaminase의 증가, 투여 부위 반응 등이 발생했다. 주사(infusion)와 관련된 부작용으로 저혈압, 오심, 구토, 땀 분비 등이 있으며, 간세포 의 염증이나 손상의 징후일 수 있는 간 효소 수치의 증가가 나타났다.
약학정보원은 "렘데시비르 외에도 COVID-19 치료에 긴급 사용 중이던 항말라리아제(chloroquine, hydroxychloroquine)의 심각한 심장 부작용 위험이 제시되었 으며, 초기에 관심이 집중되었던 HIV 치료제 복합 투여(lopinavir + ritonavir)는 약 200명의 임상 연구에서 유익성이 없는 것으로 나타났다"면서 "활발한 연구 개발에도 불구하고 COVD-19의 효과적인 치료제는 아직 요원한 상태"라고 했다.
그러면서 "렘데시비르는 아직 사람에서 치료제로 승인된 바 없는 연구용 약물로 유효성, 안전성에 대한 입증이 필요하다"며 "현재 국내에서도 렘데시비르의 COVID-19 중증도별 3상 임상, 경증~중증 환자 대상 연구자 임상이 진행 중이며, 적절하게 설계된 대규모의 렘데시비르 임상을 통해 사 망률 감소와 같은 COVID-19 치료제로서 임상적 유효성과 안전성 이슈에 대한 충분한 근거가 제시돼야 할 것"이라고 강조했다.
9일 약학정보원 학술정보센터는 코로나19 치료제로 활용·연구되는 렘데시비르 팜리뷰를 통해 이같이 밝히면서, 제대로 설계된 추가 임상시험이 필요하다고 제언했다.
렘데시비르(remdesivir, GS-5734)는 구조적으로 뉴클레오시드 유사체(nucleoside analog)다. 처음 개발 된 형태는 GS-441524로 코로나바이러스에 의한 고양이의 전염성 복막염(FIP) 치료제로 승인된 약물인데, 여기에 인산기를 포함하는 그룹을 추가했다.
RNA-의존성 RNA 중합효소(RNA-dependent RNA polymerase, RdRp)를 타겟으로 하며, 길리어드 사이언스는 에볼라 바이러스 치료제 개발 중 GS-441524의 효능을 확인하고 이 구조를 최적화해 렘데시비르(GS-5734)를 도출했다.
전구약물(prodrug)인 렘데시비르는 정맥 주사 후, 체내에서 세포 대사를 통해 활성형인 GS-443902로 변환돼 ATP와 유사한 구조로서 RNA 중합효소를 저해한다.
최근 미국국립보건원(NIH) 산하 기관인 알레르기 감염병 연구소(NIAID)에서 발표한 대규모 임상 초기 데이터에서 렘데시비르(remdesivir)가 중증 COVID-19 환자의 회복 기간을 감소시키는 것으로 나타났다.
이에 따라 미국 식품의약국(FDA)은 5월 1일 호흡 장애로 인공호흡기 등이 필요 한 COVID-19 중증 입원 환자에 렘데시비르의 긴급 사용 승인(Emergency Use Authorization, EAU)을 발표했다.
긴급 사용 승인은 연구 진행 중인 단계로 대체 약이 없는 상황 등에서 의약품 사용이 가능하도록 하는 조치다.
다만 약학정보원은 아직 사람에서 치료제로 정식 승인되지 않은 약물로, 안전성과 유효성에 대한 입증이 필요하다고 밝혔다.
약학정보원은 "코로나바이러스의 RNA-의존성 RNA 중합효소가 RNA를 합성하며, 렘데시비르는 호흡기 상피 세포에서 이 효소를 억제해 코로나바이러스의 복제를 막는다"면서 "뉴클레오시드 분자와 구조가 비슷한 렘데시비르는 체내에 서 활성형인 렘데시비르 삼인산으로 변환되는데, 이는 아데노신 삼인산(ATP)과 유사한 구조로 자연적으로 존재하는 ATP와 경쟁해 중합 과정에서 대신 삽입, 복제 과정을 중단시킨다"고 설명했다.
이어 "특징적인 것은 사슬에 삽입돼 즉각적으로 합성을 차단하는 여타의 사슬 종결제와 달리, 렘데시비르는 연장 중인 RNA 사슬에 몇 개 염기를 추가된 후 합성을 종료시키는 지연사슬 종료(delayed chain-termination)를 일으킨다"고 덧붙였다.
현재 미국에 이어 우리나라도 렘데시비르에 대해 특례수입을 허가해 중증환자에 쓸 수 있도록 하고 있다.
그러나 약학정보원은 "미국의 최초 확진자에서 렘데시비르의 동정적 사용(compassionate use)으로 증상이 호전되면서 COVID-19 치료 후보로서 가능성이 제시돼 임상 시험이 진행되고 있다"면서 "지난 4월 NEJM 저널에 발표된 렘데시비르 임상 결과에서도 투여 후 53명 중 36명의 중증환자가 임상적 개선을 보였으나, 대조군 없이 진행되어 결과 해석에 한계가 있다"고 밝혔다.
이어 "미국 알레르기 감염병 연구소(NIAID)가 진행한 1063명의 대규모 3상 임상에서 렘데시비르 복용 시, 위약 대비 회복에 걸리는 시간을 31% 단축했다"면서 "이 역시 통계적으로 유의하지 않은 것으로 나타났다"고 설명했다.
이외에도 란셋 저널에는 중국에서 수행한 237명 대상 임상에서 렘데시비르가 위약 대비 임상적 개선에 이르는 시간을 단축시켰으나, 통계적으로 유의하지 않다는 상반된 결과를 보고했다.
약학정보원은 "연구 결과 해석에 논란이 있으며 연구마다 상반된 결과가 제시되고 있어 최종 유효성 결과에 관심이 쏠리고 있다"면서 "더욱이 안전성 역시 논란이 있어 진행 중인 대규모 임상 결과를 통해 안전성 평가가 가능할 것"이라고 밝혔다.
실제 그간 연구에서 렘데시비르의 흔한 부작용으로는 호흡 부전, 혈중 알부민 수치 감소, 칼슘 수치, 적혈구 수, 혈소판 수의 저하 등이 나타났고, 이외에도 위장관 장애, 혈중 간효소 transaminase의 증가, 투여 부위 반응 등이 발생했다. 주사(infusion)와 관련된 부작용으로 저혈압, 오심, 구토, 땀 분비 등이 있으며, 간세포 의 염증이나 손상의 징후일 수 있는 간 효소 수치의 증가가 나타났다.
약학정보원은 "렘데시비르 외에도 COVID-19 치료에 긴급 사용 중이던 항말라리아제(chloroquine, hydroxychloroquine)의 심각한 심장 부작용 위험이 제시되었 으며, 초기에 관심이 집중되었던 HIV 치료제 복합 투여(lopinavir + ritonavir)는 약 200명의 임상 연구에서 유익성이 없는 것으로 나타났다"면서 "활발한 연구 개발에도 불구하고 COVD-19의 효과적인 치료제는 아직 요원한 상태"라고 했다.
그러면서 "렘데시비르는 아직 사람에서 치료제로 승인된 바 없는 연구용 약물로 유효성, 안전성에 대한 입증이 필요하다"며 "현재 국내에서도 렘데시비르의 COVID-19 중증도별 3상 임상, 경증~중증 환자 대상 연구자 임상이 진행 중이며, 적절하게 설계된 대규모의 렘데시비르 임상을 통해 사 망률 감소와 같은 COVID-19 치료제로서 임상적 유효성과 안전성 이슈에 대한 충분한 근거가 제시돼야 할 것"이라고 강조했다.


