식품의약품안전처는 의약품 제약사‧수입사에 종사하는 의약품 안전관리책임자 등을 대상으로 '시판 후 안전관리 정책 설명회'를 오는 4일 서울 그랜드컨벤션센터(서울시 영등포구 소재)에서 연다.
시판 후 안전관리 기준(GVP, Good Pharmacovigilance Practice)은 약물감시계획 수립, 의약품 위해감소 전략, 시판 후 부작용 모니터링, 부작용 정기보고, 실마리 정보 분석 등 의약품 허가부터 사용단계까지 전 과정의 안전성 정보를 체계적으로 수집‧평가하는 기준을 말한다.
이번 설명회는 최근 개정된 의약품에 대한 시판 후 안전관리 규정과 미이행 시 적용되는 행정처분 내용을 안내함으로써 시판 후 약물감시 실효성을 확보하고 의약품 안전관리를 강화하기 위해 마련되었다.
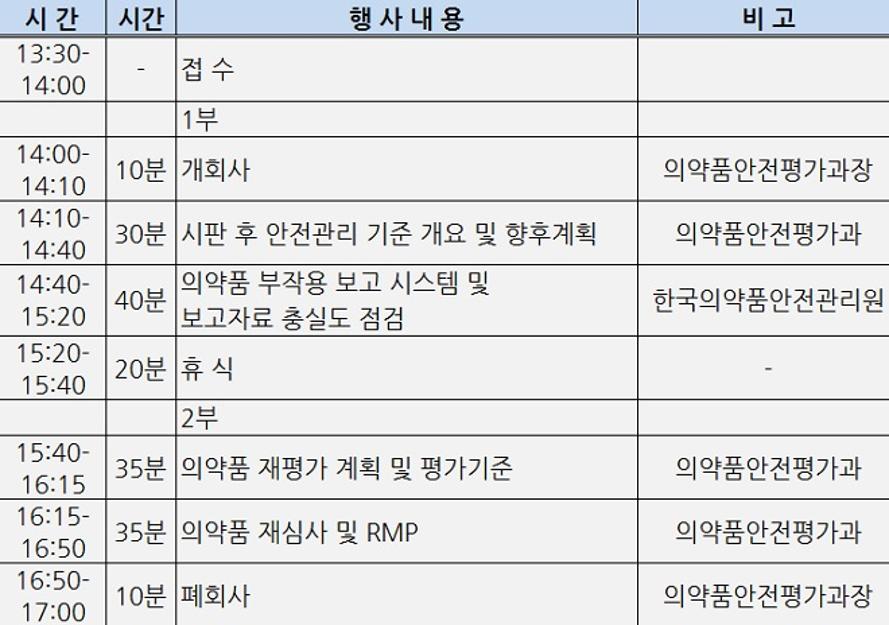
주요내용은 ▲최근 시판 후 의약품 안전관리 개정 사항 안내 ▲시판 후 안전관리 기준(GVP) 개요 및 향후계획 안내 ▲의약품 부작용 보고 시스템 및 보고자료 충실도 점검 ▲의약품 재평가 계획 및 평가기준 설명 등이다.
시판 후 안전관리 기준(GVP, Good Pharmacovigilance Practice)은 약물감시계획 수립, 의약품 위해감소 전략, 시판 후 부작용 모니터링, 부작용 정기보고, 실마리 정보 분석 등 의약품 허가부터 사용단계까지 전 과정의 안전성 정보를 체계적으로 수집‧평가하는 기준을 말한다.
이번 설명회는 최근 개정된 의약품에 대한 시판 후 안전관리 규정과 미이행 시 적용되는 행정처분 내용을 안내함으로써 시판 후 약물감시 실효성을 확보하고 의약품 안전관리를 강화하기 위해 마련되었다.
주요내용은 ▲최근 시판 후 의약품 안전관리 개정 사항 안내 ▲시판 후 안전관리 기준(GVP) 개요 및 향후계획 안내 ▲의약품 부작용 보고 시스템 및 보고자료 충실도 점검 ▲의약품 재평가 계획 및 평가기준 설명 등이다.

