[메디게이트뉴스 서민지 기자] 임상시험의 안전관리가 보다 강화된다. 향후 임상시험 약의 모든 정보를 평가, 보고하는 것이 의무화된다.
식품의약품안전처 임상제도과는 지난 26일 의약품 임상시험 온라인 정책 설명회를 통해 이 같이 밝혔다.
지난해 식약처는 임상시험발전 5개년 종합계획을 세웠다.

해당 계획에는 ▲임상시험 의뢰자의 정기적 안전성 정보 보고를 의무화하고, ▲임상시험용 의약품 안전성 정보를 평가·관리하는 가이드라인을 마련하는 한편 ▲임상시험용 의약품 안전성 정보 보고를 단계적(2021년 개발신약→2023년 전품목)으로 의무화하는 내용이 담겨 있다.
이에 따라 식약처는 임상시험 안전성 정보를 의무화하는 세부규정을 만들고, 보고 시스템과 심사관리 체계 구축에 나선 것이다.
해당 시스템을 올해 안으로 마련한 후 내년부터 본격 시행할 방침이다.
그간 임상시험 의뢰자는 중대하고 예측하지 못한 부작용(SUSAR)만 개별적으로 보고해왔으나, 정기적 보고 의무화에 따라 임상시험약의 모든 정보를 보고하는 것으로 바뀌었다.
의무 보고는 문헌, 관찰연구 등을 포함한 안전성 정보를 종합적으로 평가한 후 정기적으로 보고서를 제출하는 방식으로 이뤄진다.
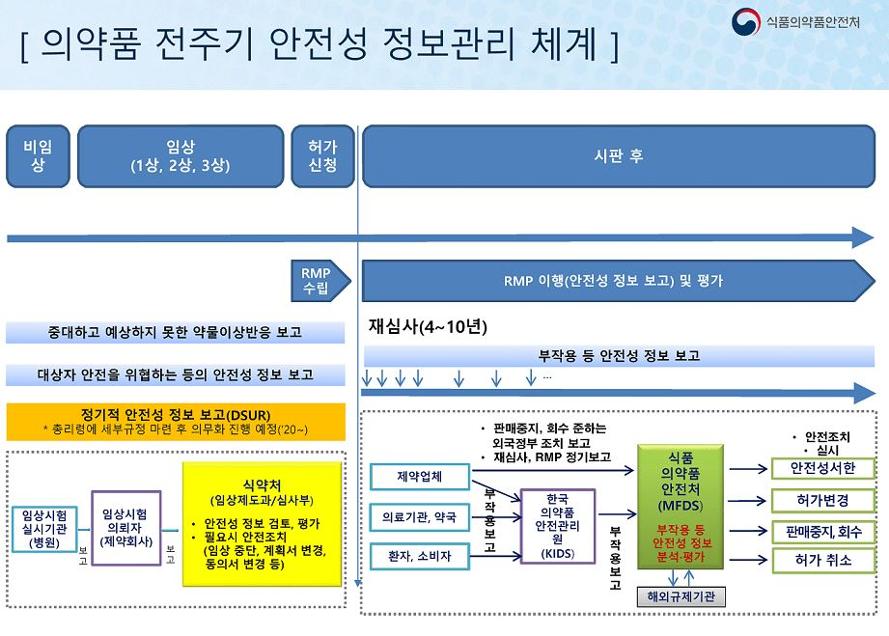
또한 식약처는 5개년 계획에 따라 임상시험용 의약품 안전성 정보를 신속보고하는 체계도 마련했다. 사망이나 생명 위협시 7일 이내, 예상치 못한 중대 이상약물반응은 15일이내, 시판 후 임상시험(4상) 중 발생한 이상반응은 15일 이내 한국의약품안전관리원에 보고하고, 식약처는 사안에 맞게 임상시험의뢰자에 임상시험계획서 변경, 시험대상자 추가모집 중단, 임상시험 중단 등 후속조치를 명하게 된다.
이외에도 식약처는 임상시험 사전·사후관리를 보다 강화해 나갈 예정이다.
이를 위해 다음달부터 임상시험 실태조사 결과를 공개하고, 이를 위해 전문가 협의체를 운영할 계획이다. 또한 장기가 대상자 등록이 없거나 장기적으로 중단되 임상시험에 대해 관리하는 방안도 마련한다.
한편 식약처는 올해 안으로 임상시험 변경 승인제도도 개선할 전망이다.
이를 위해 신청인의 변경에서 ▲대상자 수의 유의한 변경, 대상자 선정 기준의 변경, 대상자 제외 기준의 변경 또는 중도탈락 기준의 완화, ▲시험설계의 변경으로서 시험군 또는 대조군의 추가 또는 제외, ▲시험종료 및 조기 중단 기준의 변경, ▲시험의 방법 및 투약계획 등의 변경으로서 투약 방법 또는 투약기간의 변경 부분의 개정이 추진된다. 변경승인 대상을 축소하고 변경보고 대상은 확대하는 방향이다.
다만 식약처 김희선 사무관은 "아직 법제처 검토 등이 남아 있는 사안이라 수정, 보완될 가능성이 있다"고 설명했다.
일반적인 임상시험의 안전 관리는 강화되는 반면, 코로나19 치료제·백신의 임상시험일 경우 시급성을 인정해 '신속 승인' 등 정책적인 지원을 추진할 예정이다.
식약처 김지애 사무관은 "코로나19 관련 임상에 한해서 신속 심사·승인을 진행하고 있으며, 비대면 환자 동의도 허용하고 있다"면서 "코로나19 지정 병원 중 임상시험실시기관이 아닌 곳이 많은 점을 고려해 공동심사위원회를 활용할 수 있도록 지원하고 있으며 우선 심의할 수 있도록 하고 있다"고 밝혔다.
식품의약품안전처 임상제도과는 지난 26일 의약품 임상시험 온라인 정책 설명회를 통해 이 같이 밝혔다.
지난해 식약처는 임상시험발전 5개년 종합계획을 세웠다.
해당 계획에는 ▲임상시험 의뢰자의 정기적 안전성 정보 보고를 의무화하고, ▲임상시험용 의약품 안전성 정보를 평가·관리하는 가이드라인을 마련하는 한편 ▲임상시험용 의약품 안전성 정보 보고를 단계적(2021년 개발신약→2023년 전품목)으로 의무화하는 내용이 담겨 있다.
이에 따라 식약처는 임상시험 안전성 정보를 의무화하는 세부규정을 만들고, 보고 시스템과 심사관리 체계 구축에 나선 것이다.
해당 시스템을 올해 안으로 마련한 후 내년부터 본격 시행할 방침이다.
그간 임상시험 의뢰자는 중대하고 예측하지 못한 부작용(SUSAR)만 개별적으로 보고해왔으나, 정기적 보고 의무화에 따라 임상시험약의 모든 정보를 보고하는 것으로 바뀌었다.
의무 보고는 문헌, 관찰연구 등을 포함한 안전성 정보를 종합적으로 평가한 후 정기적으로 보고서를 제출하는 방식으로 이뤄진다.
또한 식약처는 5개년 계획에 따라 임상시험용 의약품 안전성 정보를 신속보고하는 체계도 마련했다. 사망이나 생명 위협시 7일 이내, 예상치 못한 중대 이상약물반응은 15일이내, 시판 후 임상시험(4상) 중 발생한 이상반응은 15일 이내 한국의약품안전관리원에 보고하고, 식약처는 사안에 맞게 임상시험의뢰자에 임상시험계획서 변경, 시험대상자 추가모집 중단, 임상시험 중단 등 후속조치를 명하게 된다.
이외에도 식약처는 임상시험 사전·사후관리를 보다 강화해 나갈 예정이다.
이를 위해 다음달부터 임상시험 실태조사 결과를 공개하고, 이를 위해 전문가 협의체를 운영할 계획이다. 또한 장기가 대상자 등록이 없거나 장기적으로 중단되 임상시험에 대해 관리하는 방안도 마련한다.
한편 식약처는 올해 안으로 임상시험 변경 승인제도도 개선할 전망이다.
이를 위해 신청인의 변경에서 ▲대상자 수의 유의한 변경, 대상자 선정 기준의 변경, 대상자 제외 기준의 변경 또는 중도탈락 기준의 완화, ▲시험설계의 변경으로서 시험군 또는 대조군의 추가 또는 제외, ▲시험종료 및 조기 중단 기준의 변경, ▲시험의 방법 및 투약계획 등의 변경으로서 투약 방법 또는 투약기간의 변경 부분의 개정이 추진된다. 변경승인 대상을 축소하고 변경보고 대상은 확대하는 방향이다.
다만 식약처 김희선 사무관은 "아직 법제처 검토 등이 남아 있는 사안이라 수정, 보완될 가능성이 있다"고 설명했다.
일반적인 임상시험의 안전 관리는 강화되는 반면, 코로나19 치료제·백신의 임상시험일 경우 시급성을 인정해 '신속 승인' 등 정책적인 지원을 추진할 예정이다.
식약처 김지애 사무관은 "코로나19 관련 임상에 한해서 신속 심사·승인을 진행하고 있으며, 비대면 환자 동의도 허용하고 있다"면서 "코로나19 지정 병원 중 임상시험실시기관이 아닌 곳이 많은 점을 고려해 공동심사위원회를 활용할 수 있도록 지원하고 있으며 우선 심의할 수 있도록 하고 있다"고 밝혔다.


