[메디게이트뉴스 윤영식 기자] 암 치료 및 진단에 유전체학이 접목된 이후 가장 많이 사용되고 있는 단어는 '정밀 의학(Precision medicine)'이었다. 그 이후 새롭게 '정밀 종양학(Precision oncology)'이란 용어를 사용하기 시작했는데, 이 용어의 정의는 계속해서 변화하고 있는 듯 하다.
몇 년 전만 해도 정밀 종양학은 넓은 범위의 정의로 사용됐지만, 2016년부터는 다수에 의해 차세대 시퀀싱(NGS) 기술로 암 조직 검사를 수행하고 이를 근거로 표적 치료하는 것으로 그 정의가 좁아졌다.
국내에서도 복지부 고시를 통해 지난 해 3월 1일부터 '차세대염기서열분석기반(NGS) 유전자패널검사'에 대한 행위료를 신설해 세계에서 처음으로 암 유전체 검사에 대해 보험급여을 적용하고 있다. 그 덕분에 무려 43개 병원이 참여해 자체적으로 NGS 임상 검사실을 구축하고, 암 환자를 대상으로 수십 개에서 수백 개에 이르는 암 유전자를 스크리닝 하는 암 유전체 검사를 제공하고 있다.
이로 인해 임상 의사들의 관심 또한 높아지고 있다. 암 유전체 분야는 기술의 발전도 물론 중요하지만, 실제 환자를 대상으로 '정밀 종양학'(Precision oncology)을 적용하는 부분이 무엇보다 중요하다. 임상 의사가 관심을 갖고 주도적으로 이 기술에 대한 이점과 한계를 명확히 인지하고, 다양한 경험을 쌓아 그 노하우를 활용하는 것이 더 중요하다 할 수 있다.
이 기술을 처음 적용한 미국 병원들의 성공적인 임상사례 발표들을 살펴보면, 대체적으로 병원에서 환자를 대상으로 처음 검사를 진행할 때 관리운용규정(SOP, Standard operating procedure)도 없고 경험도 없어 어려움을 겪었다. 그러나 임상 의사를 중심으로 병리 전문가와 유전체 전문가가 함께 참여해 협업한 결과, 다양한 성공적 환자 케이스를 경험할 수 있었고 이를 이삼년 정도 진행하면서 안정적인 운영이 가능해졌다고 한다. 해당 사례처럼, 국내 병원에서도 다양한 경험을 통해 최적의 방식을 찾는다면 충분히 환자들에게 큰 도움이 될 수 있을 것으로 기대할 수 있다.
최근에 와서는 미국 식품의약국(FDA)이 2017년 11월에 암 환자 조직을 분석해 암 체세포 변이를 분석하는 메모리얼 슬론 케터링 암센터(Memorial Sloan Kettering Cancer Center)의 468개 유전자 암 패널 검사인 'MSK-IMPACT'를 처음으로 승인하기도 했다.
여기에 이어 지난해 4월 워싱턴에서 열린 미국암학회(AACR)에서 정밀 종양학과 관련해 발표된 내용들을 몇 가지 소개해보고자 한다.
미국암학회는 외과의사 및 병리 의사의 아버지라고 불리우는 윌리엄 콜리(William B Coley) 박사가 최초로 설립한 학회다. 1907년 5월 7일 11명의 과학자가 코넬대학에 모여 처음 시작한 학회로, 첫 학술대회 참석자는 20명 정도였다고 한다. 이런 학회가 110년 만인 2017년에는 AACR17 연례 행사에만 2만 2천 명이 공식적으로 등록하는 학회로 성장했다. 암 치료에 있어 가장 중요한 암 유전체 및 임상 빅데이터를 모으자는 취지에서, 미국암학회가 후원하고 전 세계 주요 8개 암 센터(다나파보, 존스홉킨스, MD앤드슨, 슬론케터링 암센터 등)가 협력해 'GENIE 프로젝트'(현재 약 1만 9천 명의 환자의 암 유전체와 임상 정보가 공개 됐다)를 공식 발표했다. 특히, 이 프로젝트는 접하기 힘든 희귀 암들에 대한 연구 데이터가 많이 존재해 매우 유용할 것으로 생각된다.
그리고 'p53 유전자'를 발견한 유명 과학자인 존스홉킨스의 보겔슈타인(Bert Vogelstein) 박사는 암의 조기 진단에 관한 발표를 했다. 다음 혁신은 새로운 암 치료와 암 예방법을 합쳐서 적용함으로써 암의 사망률을 낮추는 것에 있다. 항암제 내성에 대한 근본적인 원인은 항암제를 투여하기 이전부터 이미 항암제 내성 암세포들이 존재한다는 것에 있다. 보겔슈타인은 본인이 "쥐의 암 치료는 할 수 있지만 사람의 치료는 할 수 없다"고 했다. 그는 "만약 당신이 암에 걸린 쥐라면 자신의 실험실에서도 치료를 할 수 있을지 모른다"며 중요한 화두를 던졌다. 아주 기본적인 산술을 언급하며 마우스에서 발생하는 종양은 기본적으로 사람의 종양보다 1000배 작고, 확률적으로 돌연변이 수도 적기 때문에 사람을 마우스로 바꾸기만 하면 자신은 암을 치료할 수 있다는 것이다. 보겔슈타인은 이를 조기 진단에 빗대어 "암의 조기 진단은 사람의 종양을 마우스의 종양처럼 작게 만드는 효과가 있다"며 실제 종양의 크기에 따라 치료와 완치율이 달라지듯이 조기 진단 및 모니터링의 중요성에 대한 통찰을 제공했다.

사진: 미국 암 학회(AACR17)에서 암 조기 진단에 대해 발표하는 보겔슈타인(Bert Vogelstein) 박사(©테라젠 김태형 이사)
또한, 자신의 동료 토마세띠(Tomasetti)를 언급하며 암 돌연변이가 발생하는 주요 원인은 유전적·환경적 요인 및 세포 복제의 오류(전체 돌연변이 중 65% 이상)에 있다고 말했다. 너무 당연한 이야기이지만, 4기(11% 생존률) 암은 100% 1기(94% 생존률) 암에서 시작하니 조기에 내부의 적(암)을 인지하는 것이 매우 중요하다고 강조했다. 즉 정확한 조기 진단을 위해서는 기존 액체생검을 통한 ctDNA 검사의 초기 암 진단 민감도(sensitivity)를 30%에서 100%까지 끌어 올려야 한다. 그는 이를 위해서는 ▲체세포변이 ▲DNA 메틸레이션 ▲전사체(mRNA, siRNA) ▲단백질 ▲대사체 마커들을 종합적으로 액체 생검 레벨에서 검출하는 방법을 적용할 필요가 있다고 말했다. 그리고 암 연구에 있어 2차 혁명을 성공적으로 이루기 위해서는 암의 조기진단과 예방에 집중해야 한다고 강조했다. 즉, 다음 50년의 암 연구를 준비하는 젊은 암 연구자들은 악성종양을 치료하는 것뿐만 아니라 초기 암을 예방하는 것에 초점을 맞춰 암 연구의 커리어를 쌓아가야 한다는 것이다. 개인적으로 느끼기에 매우 인상적인 발표였다. 신약개발 예산의 40%와 획기적인 치료제의 40%도 항암제 개발과 관련돼 있는 것을 보면, 예방에도 이만큼의 투자가 이뤄진다면 획기적인 암 연구의 2차 혁명이 예상된다.
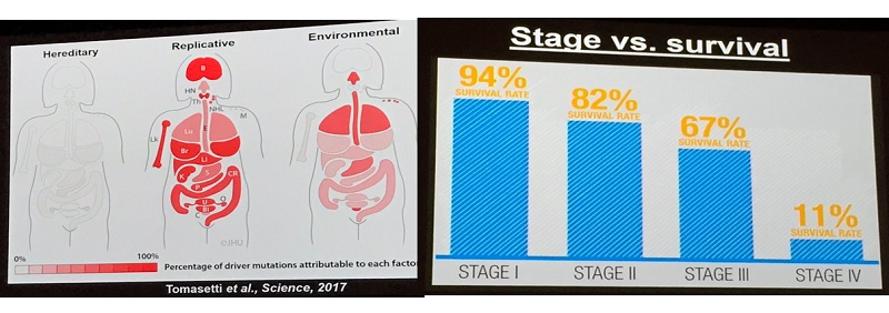
사진: 보겔슈타인(Bert Vogelstein)의 미국 암 학회(AACR17) 발표자료(©테라젠 김태형 이사)
또 다른 강연은 마이크로바이옴이 암치료에 큰 영향을 미친다는 구스타브 루시 연구소(Institute Gustave Roussy) 지트보겔(Laurence Zitvogel) 박사의 발표였다. 발표에 의하면 미생물이 면역 셋포인트(immune setpoint)를 조절하며, 특히 멀리 떨어져 있는 염증부위까지 조절하는 장 면역 시스템(Gut immune system)은 장내 미생물 군집의 불균형(dysbiosis)이라는 기능을 가지고 있다고 한다.
실제 PD1/PDL1 저해제를 처방 받은 진행형 암환자들(N=175)의 생존률이 감소했다는 그의 연구 사례를 간단히 소개하면 다음과 같다. 38명의 암 환자 중 반응군(responder)와 비반응군(non-responder)을 분석해보니 아커만시아 무시니필라(A. muciniphila)라는 비만, 당뇨병 및 염증과 관련된 미생물종이 장 간막의 T세포(T-Cell)를 활성화시켜 면역함암제의 반응성을 높이는 것으로 나왔다고 한다. 결과적으로 무시니필라 균이 많은 환자들에게서는 면역 항암제의 반응성이 좋았던 반면, 무시니필라 균이 적은 환자들에서는 면역항암제가 전혀 반응하지 않는 것을 볼 수 있었다고 한다. 그래서 장내 세균 군집의 변화를 메타게놈(Metagenomics)과 메타전사체(Metatranscriptomics)로 분석하면 면역 항암치료의 환자 개인별 반응성을 알 수 있고, 장내 세균을 잘 활용하면 항암효과를 극대화 시킬 수도 있을 것이라고 했다. 메타게놈 분석이 '기술 혁명(technical revolution)'을 가져왔다고 말하기도 했다. 실제 면역항암제가 반응하는 암환자 그룹의 1~2년 생존률은 100%였지만 반응을 하지 않는 암 환자 그룹의 1년 생존률은 33%, 2년 생존률은 11% 에 불과했다.
엘리 릴리(Eli Lilly)의 레비 게르웨이(Levi Garraway) 박사는 면역항암제와 암의 재발, 그리고 유전체 분석에 대한 경험을 통해 그들의 연결고리들을 하나하나 소개하는 멋진 발표를 선보였다. 그는 면역항암제가 가지고 있는 가장 큰 숙제는 대다수 환자들에게 반응하지 않는다는 것이라고 했다. 면역항암제의 내성에 대해서는 다차원의 원인과 이질성(heterogeneous)이 문제가 되는데 일차원적인 분석(IHC)만 가능하다며, 이를 정확하게 알기 위해서는 다양한 게놈 기술이 필요하다고 말했다. 실제로 전장엑솜유전체(WES) 데이터 분석을 통해 돌연변이의 양(mutational load)과 종양내 침윤 림프구(TIL)와 관련돼 있는 신생항원의 양(neoantigen load)을 분석할 수 있게 됐다. 돌연변이의 양(Mutational load)과 T세포(T-Cell)의 밀도는 Hot 그리고 Cold 종양을 만드는데 기여한다고 한다. 이를 통해 돌연변이의 양과 세포 활성이 면역항암제 반응성과 어떤 밀접한 관련이 있는지를 알기 위해서는 이들의 생태계를 깊이 이해해야 한다. 최근에는 단일 세포 전사체(scRNA-Seq) 분석을 통해 T-세포 수용체(T-cell receptor) 클러스터를 동정해 암 조직에서의 클론 확장(clonal expansion) 여부를 확인할 수 있다. 이를 통해 면역항암제에 저항성이 생긴 암을 보면 T 세포가 아주 많이 고갈돼 있는 것을 볼 수 있다고 한다.

사진: 미국 암 학회(AACR17)에서 면역항암제 연구에 관해 발표하는 레비 게르웨이(Levi Garraway) 박사(©테라젠 김태형 이사)
마지막으로, 브로드 연구소(Broad institute)에서 GATK를 개발하고 몇 년 전 구글의 게놈 빅데이터를 분석하는 팀의 수장이 된 마크 데프리스토(Mark DePristo)의 발표가 '인공지능(AI)을 이용한 암치료' 세션에서 진행됐다. 흥미로운 것은 그가 기존 브로드 연구소 GATK보다 더 좋은 변이 검출기(Variant caller)를 구글의 딥 러닝 네트워크를 이용해 개발하는 작업에 착수하고 있다는 것이다. 암 유전체와 같이 이질성(heterogeneity)이 높은 데이터에서 특정한 특징(feature)들을 뽑아내는데 있어 사람보다 딥러닝(deep learning)으로 처리하는 것이 더 좋다고 한다. 이미지를 처리하는데 있어서 사람의 에러율을 약 5% 정도 된다고 보는데, 2015년 이후부터는 컴퓨터의 이미지 인식 에러률이 사람 보다 더 낮아졌다고 한다. 그래서 구글은 이미 당뇨망막병증(diabetic retinopathy)을 진단하는 툴을 개발했고, 데프리스토(DePristo)팀이 암의 이질성(heterogeneity)을 처리하는 쪽으로 접근하고 있다고 하니 전 세계에서 가장 빠르게 이 문제를 해결하지 않을까 생각한다.
이처럼 정밀 종양학 관련 기술과 연구는 시간이 지날수록 빠르게 변화·발전하고 있다. 이번 학회를 통해 전 세계의 수많은 전문 연구자 및 의료기관들이 참여하는 임상연구가 진행 중에 있으며, 개별 암 환자에 맞춰 최적의 암 치료법을 찾아가고 있는 중임을 온전히 느낄 수 있었다.
[출처]
. 2017년 미국 암 학회(AACR17)
. http://www.ascopost.com/issues/january-25-2017/what-precisely-is-precision-oncology-and-will-it-work/
. http://science.sciencemag.org/content/early/2017/11/01/science.aan3706

몇 년 전만 해도 정밀 종양학은 넓은 범위의 정의로 사용됐지만, 2016년부터는 다수에 의해 차세대 시퀀싱(NGS) 기술로 암 조직 검사를 수행하고 이를 근거로 표적 치료하는 것으로 그 정의가 좁아졌다.
국내에서도 복지부 고시를 통해 지난 해 3월 1일부터 '차세대염기서열분석기반(NGS) 유전자패널검사'에 대한 행위료를 신설해 세계에서 처음으로 암 유전체 검사에 대해 보험급여을 적용하고 있다. 그 덕분에 무려 43개 병원이 참여해 자체적으로 NGS 임상 검사실을 구축하고, 암 환자를 대상으로 수십 개에서 수백 개에 이르는 암 유전자를 스크리닝 하는 암 유전체 검사를 제공하고 있다.
이로 인해 임상 의사들의 관심 또한 높아지고 있다. 암 유전체 분야는 기술의 발전도 물론 중요하지만, 실제 환자를 대상으로 '정밀 종양학'(Precision oncology)을 적용하는 부분이 무엇보다 중요하다. 임상 의사가 관심을 갖고 주도적으로 이 기술에 대한 이점과 한계를 명확히 인지하고, 다양한 경험을 쌓아 그 노하우를 활용하는 것이 더 중요하다 할 수 있다.
이 기술을 처음 적용한 미국 병원들의 성공적인 임상사례 발표들을 살펴보면, 대체적으로 병원에서 환자를 대상으로 처음 검사를 진행할 때 관리운용규정(SOP, Standard operating procedure)도 없고 경험도 없어 어려움을 겪었다. 그러나 임상 의사를 중심으로 병리 전문가와 유전체 전문가가 함께 참여해 협업한 결과, 다양한 성공적 환자 케이스를 경험할 수 있었고 이를 이삼년 정도 진행하면서 안정적인 운영이 가능해졌다고 한다. 해당 사례처럼, 국내 병원에서도 다양한 경험을 통해 최적의 방식을 찾는다면 충분히 환자들에게 큰 도움이 될 수 있을 것으로 기대할 수 있다.
최근에 와서는 미국 식품의약국(FDA)이 2017년 11월에 암 환자 조직을 분석해 암 체세포 변이를 분석하는 메모리얼 슬론 케터링 암센터(Memorial Sloan Kettering Cancer Center)의 468개 유전자 암 패널 검사인 'MSK-IMPACT'를 처음으로 승인하기도 했다.
여기에 이어 지난해 4월 워싱턴에서 열린 미국암학회(AACR)에서 정밀 종양학과 관련해 발표된 내용들을 몇 가지 소개해보고자 한다.
미국암학회는 외과의사 및 병리 의사의 아버지라고 불리우는 윌리엄 콜리(William B Coley) 박사가 최초로 설립한 학회다. 1907년 5월 7일 11명의 과학자가 코넬대학에 모여 처음 시작한 학회로, 첫 학술대회 참석자는 20명 정도였다고 한다. 이런 학회가 110년 만인 2017년에는 AACR17 연례 행사에만 2만 2천 명이 공식적으로 등록하는 학회로 성장했다. 암 치료에 있어 가장 중요한 암 유전체 및 임상 빅데이터를 모으자는 취지에서, 미국암학회가 후원하고 전 세계 주요 8개 암 센터(다나파보, 존스홉킨스, MD앤드슨, 슬론케터링 암센터 등)가 협력해 'GENIE 프로젝트'(현재 약 1만 9천 명의 환자의 암 유전체와 임상 정보가 공개 됐다)를 공식 발표했다. 특히, 이 프로젝트는 접하기 힘든 희귀 암들에 대한 연구 데이터가 많이 존재해 매우 유용할 것으로 생각된다.
그리고 'p53 유전자'를 발견한 유명 과학자인 존스홉킨스의 보겔슈타인(Bert Vogelstein) 박사는 암의 조기 진단에 관한 발표를 했다. 다음 혁신은 새로운 암 치료와 암 예방법을 합쳐서 적용함으로써 암의 사망률을 낮추는 것에 있다. 항암제 내성에 대한 근본적인 원인은 항암제를 투여하기 이전부터 이미 항암제 내성 암세포들이 존재한다는 것에 있다. 보겔슈타인은 본인이 "쥐의 암 치료는 할 수 있지만 사람의 치료는 할 수 없다"고 했다. 그는 "만약 당신이 암에 걸린 쥐라면 자신의 실험실에서도 치료를 할 수 있을지 모른다"며 중요한 화두를 던졌다. 아주 기본적인 산술을 언급하며 마우스에서 발생하는 종양은 기본적으로 사람의 종양보다 1000배 작고, 확률적으로 돌연변이 수도 적기 때문에 사람을 마우스로 바꾸기만 하면 자신은 암을 치료할 수 있다는 것이다. 보겔슈타인은 이를 조기 진단에 빗대어 "암의 조기 진단은 사람의 종양을 마우스의 종양처럼 작게 만드는 효과가 있다"며 실제 종양의 크기에 따라 치료와 완치율이 달라지듯이 조기 진단 및 모니터링의 중요성에 대한 통찰을 제공했다.
또한, 자신의 동료 토마세띠(Tomasetti)를 언급하며 암 돌연변이가 발생하는 주요 원인은 유전적·환경적 요인 및 세포 복제의 오류(전체 돌연변이 중 65% 이상)에 있다고 말했다. 너무 당연한 이야기이지만, 4기(11% 생존률) 암은 100% 1기(94% 생존률) 암에서 시작하니 조기에 내부의 적(암)을 인지하는 것이 매우 중요하다고 강조했다. 즉 정확한 조기 진단을 위해서는 기존 액체생검을 통한 ctDNA 검사의 초기 암 진단 민감도(sensitivity)를 30%에서 100%까지 끌어 올려야 한다. 그는 이를 위해서는 ▲체세포변이 ▲DNA 메틸레이션 ▲전사체(mRNA, siRNA) ▲단백질 ▲대사체 마커들을 종합적으로 액체 생검 레벨에서 검출하는 방법을 적용할 필요가 있다고 말했다. 그리고 암 연구에 있어 2차 혁명을 성공적으로 이루기 위해서는 암의 조기진단과 예방에 집중해야 한다고 강조했다. 즉, 다음 50년의 암 연구를 준비하는 젊은 암 연구자들은 악성종양을 치료하는 것뿐만 아니라 초기 암을 예방하는 것에 초점을 맞춰 암 연구의 커리어를 쌓아가야 한다는 것이다. 개인적으로 느끼기에 매우 인상적인 발표였다. 신약개발 예산의 40%와 획기적인 치료제의 40%도 항암제 개발과 관련돼 있는 것을 보면, 예방에도 이만큼의 투자가 이뤄진다면 획기적인 암 연구의 2차 혁명이 예상된다.
또 다른 강연은 마이크로바이옴이 암치료에 큰 영향을 미친다는 구스타브 루시 연구소(Institute Gustave Roussy) 지트보겔(Laurence Zitvogel) 박사의 발표였다. 발표에 의하면 미생물이 면역 셋포인트(immune setpoint)를 조절하며, 특히 멀리 떨어져 있는 염증부위까지 조절하는 장 면역 시스템(Gut immune system)은 장내 미생물 군집의 불균형(dysbiosis)이라는 기능을 가지고 있다고 한다.
실제 PD1/PDL1 저해제를 처방 받은 진행형 암환자들(N=175)의 생존률이 감소했다는 그의 연구 사례를 간단히 소개하면 다음과 같다. 38명의 암 환자 중 반응군(responder)와 비반응군(non-responder)을 분석해보니 아커만시아 무시니필라(A. muciniphila)라는 비만, 당뇨병 및 염증과 관련된 미생물종이 장 간막의 T세포(T-Cell)를 활성화시켜 면역함암제의 반응성을 높이는 것으로 나왔다고 한다. 결과적으로 무시니필라 균이 많은 환자들에게서는 면역 항암제의 반응성이 좋았던 반면, 무시니필라 균이 적은 환자들에서는 면역항암제가 전혀 반응하지 않는 것을 볼 수 있었다고 한다. 그래서 장내 세균 군집의 변화를 메타게놈(Metagenomics)과 메타전사체(Metatranscriptomics)로 분석하면 면역 항암치료의 환자 개인별 반응성을 알 수 있고, 장내 세균을 잘 활용하면 항암효과를 극대화 시킬 수도 있을 것이라고 했다. 메타게놈 분석이 '기술 혁명(technical revolution)'을 가져왔다고 말하기도 했다. 실제 면역항암제가 반응하는 암환자 그룹의 1~2년 생존률은 100%였지만 반응을 하지 않는 암 환자 그룹의 1년 생존률은 33%, 2년 생존률은 11% 에 불과했다.
엘리 릴리(Eli Lilly)의 레비 게르웨이(Levi Garraway) 박사는 면역항암제와 암의 재발, 그리고 유전체 분석에 대한 경험을 통해 그들의 연결고리들을 하나하나 소개하는 멋진 발표를 선보였다. 그는 면역항암제가 가지고 있는 가장 큰 숙제는 대다수 환자들에게 반응하지 않는다는 것이라고 했다. 면역항암제의 내성에 대해서는 다차원의 원인과 이질성(heterogeneous)이 문제가 되는데 일차원적인 분석(IHC)만 가능하다며, 이를 정확하게 알기 위해서는 다양한 게놈 기술이 필요하다고 말했다. 실제로 전장엑솜유전체(WES) 데이터 분석을 통해 돌연변이의 양(mutational load)과 종양내 침윤 림프구(TIL)와 관련돼 있는 신생항원의 양(neoantigen load)을 분석할 수 있게 됐다. 돌연변이의 양(Mutational load)과 T세포(T-Cell)의 밀도는 Hot 그리고 Cold 종양을 만드는데 기여한다고 한다. 이를 통해 돌연변이의 양과 세포 활성이 면역항암제 반응성과 어떤 밀접한 관련이 있는지를 알기 위해서는 이들의 생태계를 깊이 이해해야 한다. 최근에는 단일 세포 전사체(scRNA-Seq) 분석을 통해 T-세포 수용체(T-cell receptor) 클러스터를 동정해 암 조직에서의 클론 확장(clonal expansion) 여부를 확인할 수 있다. 이를 통해 면역항암제에 저항성이 생긴 암을 보면 T 세포가 아주 많이 고갈돼 있는 것을 볼 수 있다고 한다.
마지막으로, 브로드 연구소(Broad institute)에서 GATK를 개발하고 몇 년 전 구글의 게놈 빅데이터를 분석하는 팀의 수장이 된 마크 데프리스토(Mark DePristo)의 발표가 '인공지능(AI)을 이용한 암치료' 세션에서 진행됐다. 흥미로운 것은 그가 기존 브로드 연구소 GATK보다 더 좋은 변이 검출기(Variant caller)를 구글의 딥 러닝 네트워크를 이용해 개발하는 작업에 착수하고 있다는 것이다. 암 유전체와 같이 이질성(heterogeneity)이 높은 데이터에서 특정한 특징(feature)들을 뽑아내는데 있어 사람보다 딥러닝(deep learning)으로 처리하는 것이 더 좋다고 한다. 이미지를 처리하는데 있어서 사람의 에러율을 약 5% 정도 된다고 보는데, 2015년 이후부터는 컴퓨터의 이미지 인식 에러률이 사람 보다 더 낮아졌다고 한다. 그래서 구글은 이미 당뇨망막병증(diabetic retinopathy)을 진단하는 툴을 개발했고, 데프리스토(DePristo)팀이 암의 이질성(heterogeneity)을 처리하는 쪽으로 접근하고 있다고 하니 전 세계에서 가장 빠르게 이 문제를 해결하지 않을까 생각한다.
이처럼 정밀 종양학 관련 기술과 연구는 시간이 지날수록 빠르게 변화·발전하고 있다. 이번 학회를 통해 전 세계의 수많은 전문 연구자 및 의료기관들이 참여하는 임상연구가 진행 중에 있으며, 개별 암 환자에 맞춰 최적의 암 치료법을 찾아가고 있는 중임을 온전히 느낄 수 있었다.
[출처]
. 2017년 미국 암 학회(AACR17)
. http://www.ascopost.com/issues/january-25-2017/what-precisely-is-precision-oncology-and-will-it-work/
. http://science.sciencemag.org/content/early/2017/11/01/science.aan3706


