[메디게이트뉴스 서민지 기자] 'K-제네릭'이라는 브랜드 가치를 높이기 위해 국제 기준에 준하는 품질평가를 도입하고, 생동성 입증 판정기준을 강화할 계획이다. 또한 ICT 기반의 맞춤형 정보를 제공하고 국산 원료의약품 사용을 활성화하는 한편 특허만료 품목에 대한 선제적 허가심사 기준을 제공할 방침이다.
16일 식품의약품안전처는 국내 제네릭의약품의 경쟁력 강화를 위해 지난 5월부터 '제네릭의약품 국제경쟁력 강화를 위한 민관협의체’를 운영, 21개 과제를 도출했다.
민관협의체는 제약업계, 의약사 단체, 학계, 환자단체 및 소비자단체 전문가와 식약처 관련자로 구성됐으며, 제네릭의약품 품질, 안전관리, 국재경쟁력 강화 등을 집중 논의해왔다.
2달여간의 협의를 토대로 ▲제네릭의약품의 품질 신뢰성 제고, ▲정보제공 확대, ▲제품개발촉진, ▲K-제네릭 해외진출 지원 등 4개 분야 21개 세부과제별 향후 추진 계획을 마련했다.
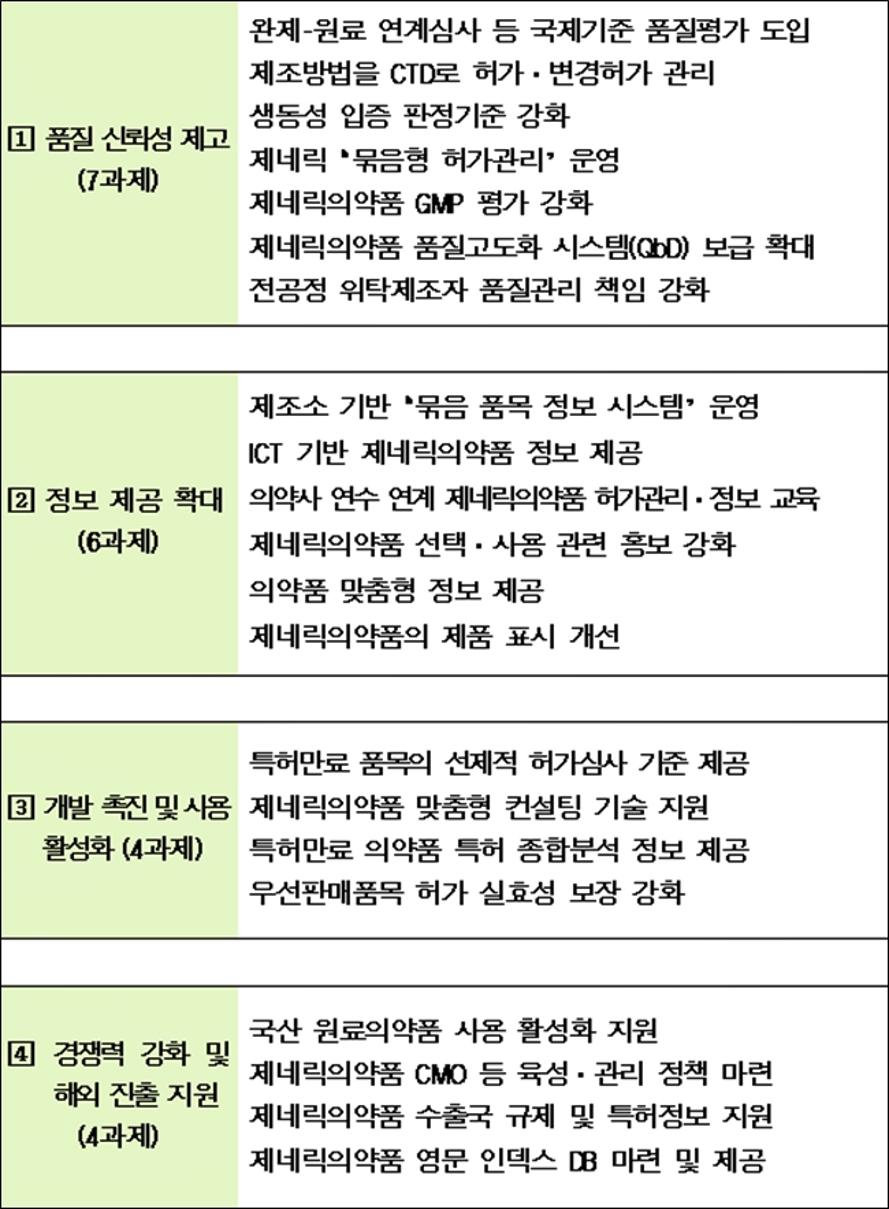
▲품질 신뢰성 제고= 이번에 마련된 주요 과제에 따르면, 국내 제네릭의약품의 품질을 전세계적으로 인정받도록 전 공정을 위탁 제조하더라도 GMP 적격성 여부를 사전에 확인한 후 허가하는 등 GMP 자료 요건을 강화하기로 했다.
또한 의약품 제조업체의 관리·운영 정도를 국민이 알 수 있도록 현장 실태조사 결과를 식약처 홈페이지에 공개할 계획이다.
안전관리 측면에서 완제의약품 심사단계에서 원료의약품 관련 불순물(NDMA 등)과 같은 위험요인을 사전에 파악해 의약품의 품질 사각지대를 해소할 예정이다.
그간 업체 자율적으로 관리를 해왔던 허가 이후 품질 및 약효에 영향을 미칠 수 있는 세부공정 변경, 원료의 입자크기 변경 등을 사전 변경 허가를 받도록 했다.
제네릭의약품의 동등성 유지를 위해 ▲주성분과 제형이 동일하고 함량이 다른 의약품(△△정 10mg, 20mg)의 경우, ▲함량이 다른 제품 간의 첨가제의 종류·배합비율이 다른 경우 등은 ‘비교용출시험’이 아닌 ‘생물학적동등성시험’으로 동등성을 입증토록 기준을 강화할 예정이다.
이외에도 원료의약품(주성분) 등록 이후 완제의약품의 품질심사를 진행하던 것을 완제의약품 심사 시 원료의약품에 관한 품질심사를 병행해 효율성을 높일 계획이다.
▲정보제공 확대= 하나의 성분인 제네릭들을 인지하기 쉽도록 '묶음정보'도 제공한다.
식약처는 홈페이지, 모바일웹 등 다양한 방법을 통해 누구든지 사용할 수 있도록 '묶음정보'를 개발했으며, 제품개발, 허가심사, 품질관리, 회수·폐기 등 안전관리에도 활용되도록 했다. 이는 동일 제조소에서 제조되고 동일 동등성시험 자료로 허가된 제네릭의약품의 목록으로, ‘제품명’, ‘업체명’, ‘의약품분류코드(ATC코드)’와 심평원 약제급여목록 상의‘주성분코드’, ‘제품코드’ 등이 포함된다.
현재 단일성분의 의약품만 제품명에 유효성분을 기재하고 있으나, 앞으로는 제품을 쉽게 구분할 수 있도록 복합성분 의약품도 제품명에 유효성분을 함께 기재할 예정이다.
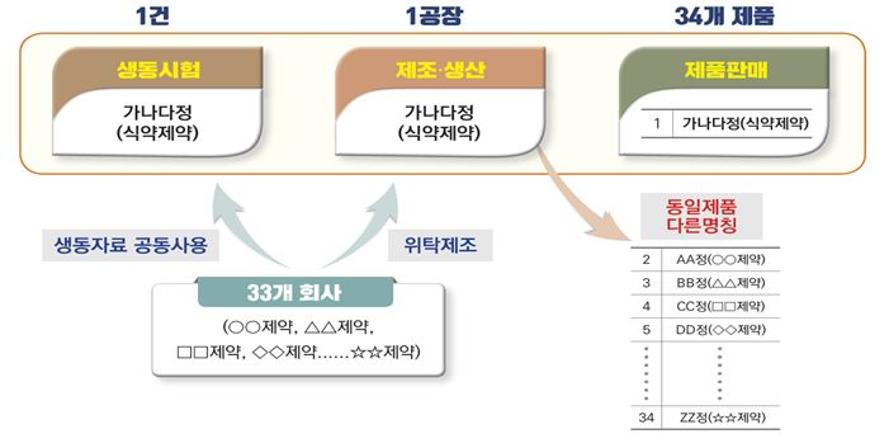
많은 제네릭의약품이 제조 위·수탁을 통해 1개 회사에서 동일하게 생산되는 제품을 다른 제품으로 인식하고 있는데, 이를 개선하기 위해 제품 외부포장에 제조소·동등성 등에 대한 정보를 표시하는 방안도 추진키로 했다.
품질·안전 관리뿐 아니라 의사·약사 인식 개선을 통해 제네릭 사용도 확대하겠다는 방침이다.
이를 위해 식약처는 앞으로 의사·약사 연수교육 과정에 의약품 허가관리 제도, 생동시험 결과 통계자료 등을 교육자료로 제공하며, 소비자단체 교육 프로그램 참여, 유튜브 등 SNS 홍보, 리플릿 배포 등 정보 제공을 이어갈 예정이다.
▲제품개발·해외진출 촉진= 맞춤형 허가 가이드라인 마련, 특허-허가 연계 종합정보 분석·공개, 특허 컨설팅 제공 등도 추진한다. 오리지널 의약품 특허에 도전하는 등 연구개발을 통해 제네릭의약품 출시를 준비하는 업체에 대한 지원을 보다 강화하려는 목적이다.
식약처 이의경 처장은 "최초 제네릭 개발 업체가 혜택을 받도록 위탁으로 품목허가를 받은 경우 '우선판매품목허가(다른 제네릭 의약품 판매금지)' 대상에서 제외해 제도의 실효성을 높일 것"이라며 "국제 경쟁력을 갖추고 해외에 나갈 수 있도록 국제 원료의약품 사용 제품을 신속 심사하고, 주요국과 상호 인정 협정(MRA)을 지속 추진하겠다"고 밝혔다.
이어 "이번에 마련한 민관협의체 추진과제 등을 조속히 현장에 적용하도록 품질평가 분야 전문심사관 26명을 채용하고, 의사·약사·소비자단체·제약업계 등과 긴밀해 소통해 나갈 것"이라고 부연했다.
16일 식품의약품안전처는 국내 제네릭의약품의 경쟁력 강화를 위해 지난 5월부터 '제네릭의약품 국제경쟁력 강화를 위한 민관협의체’를 운영, 21개 과제를 도출했다.
민관협의체는 제약업계, 의약사 단체, 학계, 환자단체 및 소비자단체 전문가와 식약처 관련자로 구성됐으며, 제네릭의약품 품질, 안전관리, 국재경쟁력 강화 등을 집중 논의해왔다.
2달여간의 협의를 토대로 ▲제네릭의약품의 품질 신뢰성 제고, ▲정보제공 확대, ▲제품개발촉진, ▲K-제네릭 해외진출 지원 등 4개 분야 21개 세부과제별 향후 추진 계획을 마련했다.
▲품질 신뢰성 제고= 이번에 마련된 주요 과제에 따르면, 국내 제네릭의약품의 품질을 전세계적으로 인정받도록 전 공정을 위탁 제조하더라도 GMP 적격성 여부를 사전에 확인한 후 허가하는 등 GMP 자료 요건을 강화하기로 했다.
또한 의약품 제조업체의 관리·운영 정도를 국민이 알 수 있도록 현장 실태조사 결과를 식약처 홈페이지에 공개할 계획이다.
안전관리 측면에서 완제의약품 심사단계에서 원료의약품 관련 불순물(NDMA 등)과 같은 위험요인을 사전에 파악해 의약품의 품질 사각지대를 해소할 예정이다.
그간 업체 자율적으로 관리를 해왔던 허가 이후 품질 및 약효에 영향을 미칠 수 있는 세부공정 변경, 원료의 입자크기 변경 등을 사전 변경 허가를 받도록 했다.
제네릭의약품의 동등성 유지를 위해 ▲주성분과 제형이 동일하고 함량이 다른 의약품(△△정 10mg, 20mg)의 경우, ▲함량이 다른 제품 간의 첨가제의 종류·배합비율이 다른 경우 등은 ‘비교용출시험’이 아닌 ‘생물학적동등성시험’으로 동등성을 입증토록 기준을 강화할 예정이다.
이외에도 원료의약품(주성분) 등록 이후 완제의약품의 품질심사를 진행하던 것을 완제의약품 심사 시 원료의약품에 관한 품질심사를 병행해 효율성을 높일 계획이다.
▲정보제공 확대= 하나의 성분인 제네릭들을 인지하기 쉽도록 '묶음정보'도 제공한다.
식약처는 홈페이지, 모바일웹 등 다양한 방법을 통해 누구든지 사용할 수 있도록 '묶음정보'를 개발했으며, 제품개발, 허가심사, 품질관리, 회수·폐기 등 안전관리에도 활용되도록 했다. 이는 동일 제조소에서 제조되고 동일 동등성시험 자료로 허가된 제네릭의약품의 목록으로, ‘제품명’, ‘업체명’, ‘의약품분류코드(ATC코드)’와 심평원 약제급여목록 상의‘주성분코드’, ‘제품코드’ 등이 포함된다.
현재 단일성분의 의약품만 제품명에 유효성분을 기재하고 있으나, 앞으로는 제품을 쉽게 구분할 수 있도록 복합성분 의약품도 제품명에 유효성분을 함께 기재할 예정이다.
많은 제네릭의약품이 제조 위·수탁을 통해 1개 회사에서 동일하게 생산되는 제품을 다른 제품으로 인식하고 있는데, 이를 개선하기 위해 제품 외부포장에 제조소·동등성 등에 대한 정보를 표시하는 방안도 추진키로 했다.
품질·안전 관리뿐 아니라 의사·약사 인식 개선을 통해 제네릭 사용도 확대하겠다는 방침이다.
이를 위해 식약처는 앞으로 의사·약사 연수교육 과정에 의약품 허가관리 제도, 생동시험 결과 통계자료 등을 교육자료로 제공하며, 소비자단체 교육 프로그램 참여, 유튜브 등 SNS 홍보, 리플릿 배포 등 정보 제공을 이어갈 예정이다.
▲제품개발·해외진출 촉진= 맞춤형 허가 가이드라인 마련, 특허-허가 연계 종합정보 분석·공개, 특허 컨설팅 제공 등도 추진한다. 오리지널 의약품 특허에 도전하는 등 연구개발을 통해 제네릭의약품 출시를 준비하는 업체에 대한 지원을 보다 강화하려는 목적이다.
식약처 이의경 처장은 "최초 제네릭 개발 업체가 혜택을 받도록 위탁으로 품목허가를 받은 경우 '우선판매품목허가(다른 제네릭 의약품 판매금지)' 대상에서 제외해 제도의 실효성을 높일 것"이라며 "국제 경쟁력을 갖추고 해외에 나갈 수 있도록 국제 원료의약품 사용 제품을 신속 심사하고, 주요국과 상호 인정 협정(MRA)을 지속 추진하겠다"고 밝혔다.
이어 "이번에 마련한 민관협의체 추진과제 등을 조속히 현장에 적용하도록 품질평가 분야 전문심사관 26명을 채용하고, 의사·약사·소비자단체·제약업계 등과 긴밀해 소통해 나갈 것"이라고 부연했다.


